Как бактерии питаются молоком
Для неё, так же, как и для всех живых существ в мире, глюкоза – самая лучшая еда. Если глюкоза есть, то всё в порядке, в этом случае ни на какие другие источники энергии можно вообще не обращать внимания. А вот если глюкозы нет, то приходится думать, чем бы её заменить или из чего добыть. И если в окружающей среде есть молочный сахар, лактоза, то это неплохой вариант: бактерия E. coli вполне способна расщепить его на два более простых вещества – глюкозу и галактозу. Для того чтобы переваривать молочный сахар, бактерия использует специальный фермент – β-галактозидазу. Этот фермент вырабатывается только тогда, когда, во-первых, в окружающей среде есть лактоза и во-вторых, отсутствует глюкоза, и, значит, её нужно добывать из других веществ.
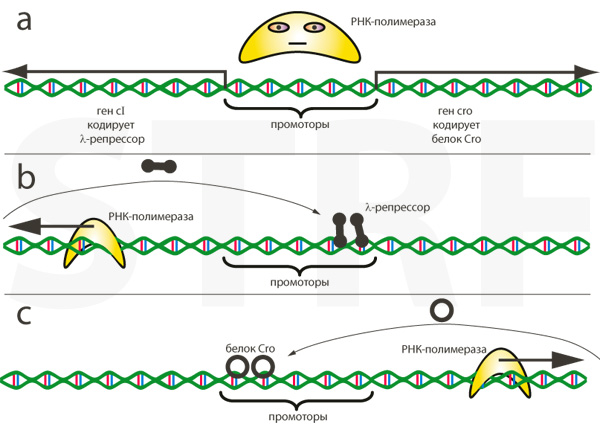
Синтез любого белка, в том числе и β-галактозидазы, начинается с транскрипции – прочтения соответствующего гена. РНК-полимераза, фермент, который читает нуклеотидную последовательность ДНК, должна присоединиться к промотору – участку, с которого начинается считывание гена (или группы генов).
В ситуации когда молочного сахара нет вообще, не производится и нужный для его переваривания фермент, β-галактозидаза. Такая экономия ресурсов достигается благодаря тому, что с промотором гена β-галактозидазы связан белок-репрессор, который физически не позволяет РНК-полимеразе связаться с ДНК и начать транскрипцию.
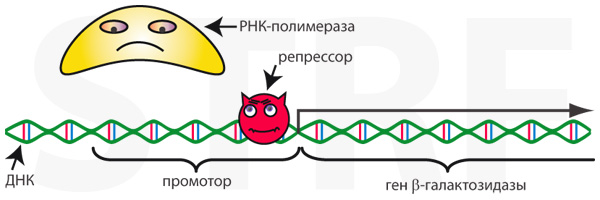
Рис. Репрессор не позволяет РНК-полимеразе связаться с промотором, и поэтому β-галактозидаза не синтезируется.
Когда в клетке появляется лактоза, она сама же и снимает запрет на производство фермента, нужного для её расщепления. Молекула лактозы связывается с белком-репрессором, в результате чего он меняет конформацию и отсоединяется от ДНК.
Теперь нужный фермент производится, но в очень незначительном количестве. Дело в том, что промоторы бывают разные: к некоторым РНК-полимераза присоединяется охотно, а к некоторым – не очень. Промотор гена β-галактозидазы слабый: он мало «привлекает» РНК-полимеразу, и нужна дополнительная «приманка».
Приманка начинает работать в том случае, если в клетке очень мало глюкозы. Значит, хочешь не хочешь, а использовать альтернативные источники пищи необходимо.
Отсутствие глюкозы – это настоящий голод, а в случае голода клетка вырабатывает молекулы-алармоны (от англ. alarm – тревога), которые служат сигналом для перестройки всей её жизнедеятельности.
В роли одного из таких посредников выступает циклический аденозинмонофосфат, цАМФ. Молекула этого вещества взаимодействует с белком, активирующим катаболизм, – CAP (catabolism activating protein), а образовавшийся комплекс связывается с промотором гена β-галактозидазы. CAP притягивает РНК-полимеразу к промотору и увеличивает вероятность того, что ген β-галактозидазы будет прочитан.
Эти два события – блокировка репрессора и активация CAP – приводят к активному производству β-галактозидазы. Клетка теперь может использовать молочный сахар в качестве пищи, что позволяет ей выйти из состояния голода и продолжить рост.
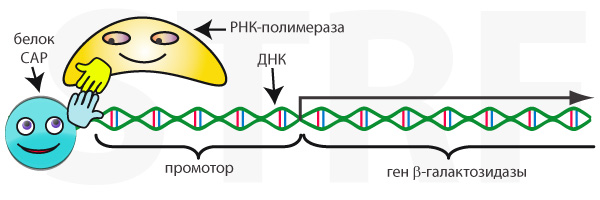
Рис. Присутствие белка CAP повышает вероятность того, что РНК-полимераза свяжется с промотором и ген начнёт считываться.
«Изучение этой системы внесло исключительно большой вклад в понимание общих принципов работы генов», – поясняет Северинов. Регуляцию лактозного оперона описали французские учёные Жак Моно (Jacques Monod) и Франсуа Жакоб (Francois Jacob), получившие впоследствии вместе с Андре Львовым (Andre Lwoff) Нобелевскую премию «за открытия, касающиеся генетического контроля синтеза ферментов и вирусов».
Лактозный оперон вошёл во все учебники, потому что он иллюстрирует базовые принципы регуляции экспрессии генов, задействованные как в ингибировании, так и в активации транскрипции. Используя эти принципы, природа составляет сколь угодно сложные генетические переключатели, которые реагируют на изменение условий внешней среды.